Взятие и пересылка патологического материала для бактериологического и вирусологического исследовании
Взятие и пересылка патологического материала для бактериологического и вирусологического исследовании
Патологический материал необходимо брать стерильными инструментами в стерильную посуду. Поверхность органа (ткани), от которого берут патологический материал, на месте разреза следует обжечь над пламенем или прижечь нагретой металлической пластинкой.
Патологический материал должен быть взят как можно раньше после смерти животного, особенно в теплое время года. Начавшееся разложение трупа может сделать его негодным для исследования.
Патологический материал отправляют в лабораторию в не консервированном виде; в том случае, если невозможно доставить его в лабораторию в течение ближайших 24–30 часов, патологический материал посылают только в консервированном виде.
Для бактериологического исследования патологический материал (органы или их части) консервируют 30%-ным водным раствором химически чистого глицерина. Воду предварительно стерилизуют кипячением или автоклавированием в течение 30 минут. Материал можно консервировать также в стерильном вазелиновом масле. Материал заливают консервирующей жидкостью в количестве, в 4–5 раз превышающем его объем.
Материал, направляемый для вирусологических исследований, консервируют. Небольшие трупы павших животных лучше посылать целыми в непроницаемой таре.
Кал для исследования отправляют в стерильных стаканах, пробирках или банках, которые хорошо закрывают пергаментной бумагой. От трупов животных кал можно послать в отрезке невскрытого кишечника, завязанного с обоих концов Кал в лабораторию должен быть доставлен не позднее 24 часов после его взятия.
Кровь, гнои, слизь, экссудат, мочу, желчь и другой жидкий патологический материал для бактериологического и вирусологического исследований посылают в запаянных пастеровских пипетках, стерильных пробирках или во флаконах, хорошо закрытых стерильными резиновыми пробками.
Кровь, гнои, выделения из различных полостей, естественных отверстий и др. посылают для микроскопического исследования (для обнаружения в них микробов, кровепаразитов и для определения лейкоцитарной формулы) в виде мазков.
Предметные стекла предварительно кипятят в течение 10–15 минут в 1–2%-ном водном растворе соды, затем хорошо промывают чистой водой и насухо вытирают. Сухие стекла помещают в раствор спирт-эфира, взятых в равных частях, где и хранят до употребления.
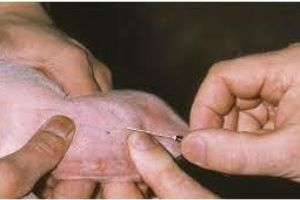
У животных кровь берут из вены ушной раковины или края верхушки уха, у птиц – с поверхности гребня или подкрыльцовой вены. Шерсть на месте взятия крови выстригают или выбривают, кожу тщательно протирают ватными тампонами, смоченными сначала спиртом и затем эфиром. Инструменты (иглы, скальпель) должны быть стерильными.
Первую каплю крови удаляют стерильной ватой (исключение делается при исследовании крови на гемоспоридиозы, когда берут для мазка первую каплю крови), а следующую свободно выступившую каплю крови берут на предварительно подготовленное предметное стекло путем быстрого и легкого прикосновения к капле поверхностью стекла. Затем стекло быстро поворачивают вверх каплей и удерживают между пальцами левой руки в горизонтальном положении. К левому краю капли прикасаются под углом 45° шлифованным краем другого предметного (или покровного) стекла. Как только капля равномерно распределится по ребру этого стекла, его быстро проводят по поверхности предметного стекла слева направо, не доводя его до края на 0,5–1 см. Ширина мазков должна быть уже предметного стекла. Для каждого нового мазка берут свежую каплю крови.
Готовые мазки крови высушивают на воздухе; подсушивать их над пламенем или на солнце не рекомендуется. В холодное время года мазки делают в теплом помещении или на стеклах, подогретых на крышке теплого стерилизатора.
Метод фиксации мазков зависит от цели исследования.
Правильно приготовленные мазки крови должны быть тонкими, равномерными и достаточной длины. На высушенных мазках и отпечатках острым предметом делают надпись с указанием номера или клички животного и даты приготовления мазка.
Мазки из тканей, гноя, органов и различных выделений готовят путем размазывания материала на предметном стекле стерильной палочкой или ребром. Другого предметного стекла до тонкого слоя. Частицы органов плотной консистенции, твердые узелки, а также вязкий материал целесообразно заключать между двумя предметными стеклами. После растирания помещенного между ними материала стекла разъединяют в противоположные стороны в горизонтальном направлении, в результате чего получаются два довольно тонких мазка. Иногда получают так называемые препараты – отпечатки. Для этого вырезанный острым скальпелем кусочек органа захватывают пинцетом и свободной поверхностью кусочка делают на стекле несколько тонких отпечатков.
Взятие и пересылка патологического материала при отдельных инфекционных болезнях
Лептоспироз. Для бактериологического исследования в лабораторию направляют нитрированную кровь, ликвор, мочу, кусочки свежих не консервированных органов (печени почки и др.).
Для гистологического исследования на наличие лептоспир от павших животных берут кусочки печени почек, лимфатических узлов и мышц сердца.
При подозрении на заболевание животных лептоспирозом посылают мазки периферической крови от больных и павших животных для исследования с целью исключения пироплазмоза.
При необходимости серологического исследования посылают кровь или сыворотку ее в пробирках.
Рожа свиней. Для бактериологического и биологического исследований лучше послать свежий труп с целью исключения чумы, пастереллеза, паратифа и других болезней. При невозможности переслать весь труп для бактериологического исследования направляют.
а) трубчатую кость и пораженные суставы, очищенные от мышц;
б) кусочки пораженной кожи селезенку, почку и сердце.
Пастереллез свиней. Для бактериологического исследования посылают:
а) от больных животных – кровь, стерильно взятую;
б) от трупов – кровь из сердца (в запаянных пипетках), части паренхиматозных органов и трубчатую кость;
Сальмонеллезы. Для бактериологического исследования в лабораторию направляют свежие паренхиматозные органы (печень с желчным пузырем и лимфатическими узлами, селезенку почку), мезентериальные лимфатические узлы трубчатую кость, а в случае аборта – плод с плодовыми оболочками и околоплодной жидкостью.
В целях выявления бактерионосителей направляют фекалии для бактериологического исследования и кровь или сыворотку крови для серологического исследования по РА.
Не рекомендуется брать материал в период применения антибиотиков. Для обнаружения сальмонелл отбор проб кала следует делать после дефекации из последней порции испражнении. При наличии в фекалиях крови, слизи, гноя, пленок их необходимо включить в пробу.
Если невозможно быстро доставить фекалии в лабораторию, их помещают в пробирку с консервирующим раствором. В качестве консерванта лучше всего применять глицериновую смесь или буферный раствор фосфорнокислых солей (рН 8,0) Количество помещенных фекалии должно составлять 1/3 объема консерванта.
Колибактериоз. Для посмертной диагностики в лабораторию направляют свежий труп или патологический материал (сердце, паренхиматозные органы, трубчатую кость, голову и мезентериальные лимфатические узлы). Для прижизненной бактериологической диагностики направляют фекальные массы от больных животных, взятые из прямой кишки в стерильные пробирки.
Диплококковая септицемия. Для бактериологического исследования направляют свежий труп или патологический материал кровь из сердца (в запаянных пипетках), селезенку, печень, лимфатические узлы, пораженный сустав, трубчатую кость, головной мозг.
При заболевании свиней метритами направляют в стерильных пробирках ватные тампоны с истечением из половых органов.
Зимой материал можно посылать замороженным. Необходимо иметь в виду, что в материале сохраняемом в теплом месте (при 16–20°), диплококки лизируются в течение 24–30 часов.
Болезнь Ауески. Для биологического исследования посылают – голову, головной мозг или же часть его (продолговатый мозг), кусочки селезенки, печени, легкого в стерильном чистом глицерине или в насыщенном растворе поваренной соли.
Чума свиней. Для исследования с целью исключения возбудителей бактериальных инфекций направляют трупы поросят, паренхиматозные органы, мезентериальные, подчелюстные, бронхиальные лимфатические узлы, трубчатые кости, толстый отдел кишечника, а также от больных животных для гематологического исследования мазки крови или стабилизированную кровь.
Африканская чума свиней. Для исследования с целью исключения возбудителей бактериальных инфекций направляют селезенку, лимфатические узлы от павших или убитых животных. От больных животных – стабилизированную кровь (для исследования по реакции гемадсорбции).
Инфекционный энцефаломиелит свиней (болезнь Тешена). Для исследования направляют трупы поросят, головной и спинной мозг. паренхиматозные органы в 30%-ном растворе глицерина .на физиологическом растворе – для биологического исследования и в спирт-ацетоне (поровну) – для гистологического
Вирусная пневмония свиней. Направляют пораженные участки легких, регионарные лимфатические узлы для биопробы и такой же материал, зафиксированный в формалине, для гистологических исследований.